政策法規 || 關于2025年版中國藥典二部凡例的公示(附法規概覽09.09-09.20)
01
關于2025年版中國藥典二部凡例的公示
國家藥典委修訂了2025年版中國藥典二部凡例。
掃描圖中二維碼
查看詳細信息

02
關于公開征求ICH《M13A: 口服固體速釋制劑的生物等效性》(含問答文件)實施建議和中文版意見的通知
為推動ICH指導原則在國內的平穩落地實施,CDE擬定了《M13A指導原則(含問答文件)實施建議》,同時組織翻譯了M13A指導原則(含問答文件)的中文版。

掃描圖中二維碼
查看詳細信息

03
關于公開征求《生物類似藥藥學相似性研究的問題與解答(征求意見稿)》意見的通知
為進一步指導和規范生物類似藥的藥學相似性研究,CDE組織起草了《生物類似藥藥學相似性研究的問題與解答(征求意見稿)》。

掃描圖中二維碼
查看詳細信息

04
國家藥監局關于修訂小兒清熱止咳制劑說明書的公告
(2024年第112號)
根據藥品不良反應評估結果,為進一步保障公眾用藥安全,國家藥品監督管理局決定對小兒清熱止咳制劑說明書中的【警示語】【不良反應】【禁忌】和【注意事項】進行了統一修訂。
掃描圖中二維碼
查看詳細信息

05
國家藥監局藥審中心關于發布《地舒單抗注射液生物類似藥(腫瘤適應癥)臨床試驗指導原則(試行)》的通告(2024年第38號)
為鼓勵新藥研發,在國家藥品監督管理局的部署下,藥審中心組織制定了《地舒單抗注射液生物類似藥(腫瘤適應癥)臨床試驗指導原則(試行)》(見附件)。根據《國家藥監局綜合司關于印發藥品技術指導原則發布程序的通知》(藥監綜藥管〔2020〕9號)要求,經國家藥品監督管理局審查同意,現予發布。

掃描圖中二維碼
查看詳細信息

06
發布《治療慢性心力衰竭藥物臨床試驗技術指導原則》的通告
慢性心力衰竭是一種嚴重的、慢性進展性、致死性的臨床綜合征,是心血管疾病的終末期表現和最主要的死因,目前仍缺乏有效的治療藥物。為了鼓勵該領域藥物創新研發,提供技術指導,藥審中心組織制定了《治療慢性心力衰竭藥物臨床試驗技術指導原則》(見附件)。根據《國家藥監局綜合司關于印發藥品技術指導原則發布程序的通知》(藥監綜藥管〔2020〕9號)要求,經國家藥品監督管理局審查同意,現予發布。

掃描圖中二維碼
查看詳細信息

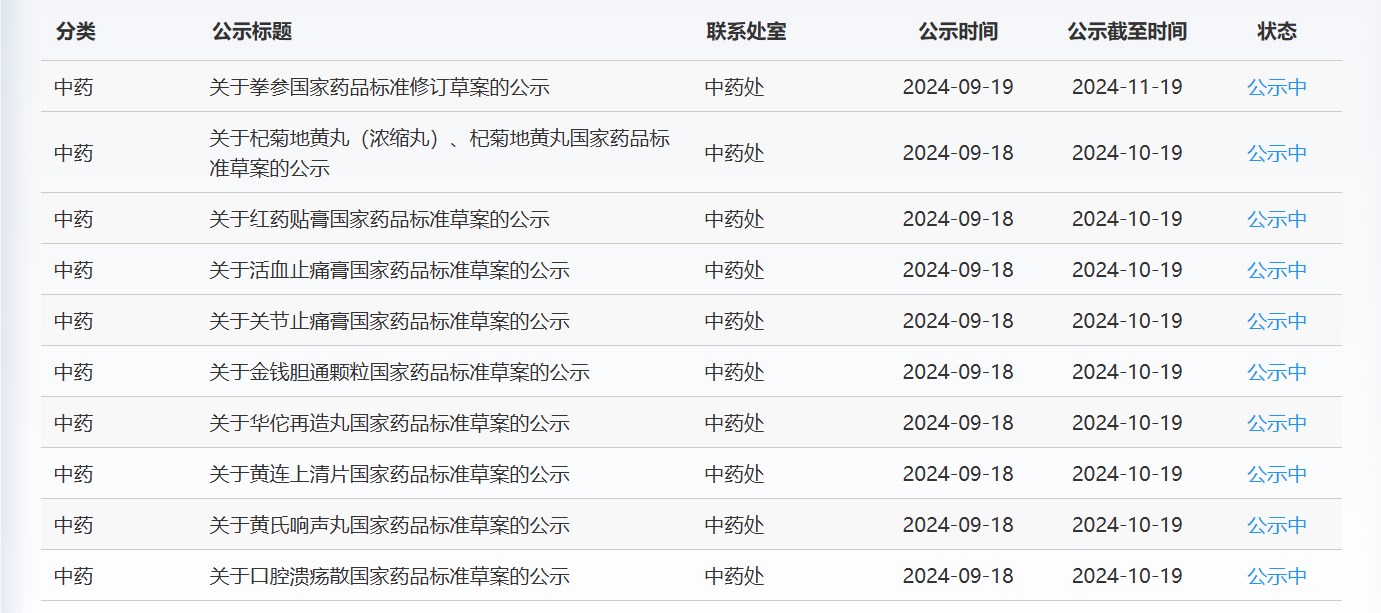
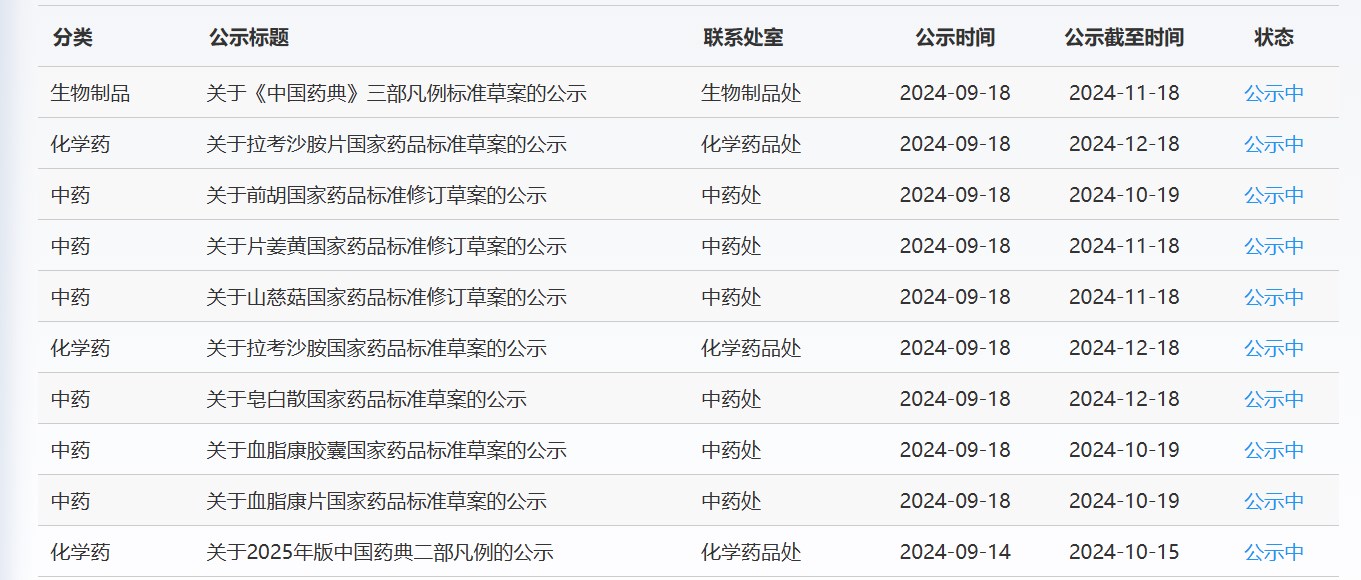
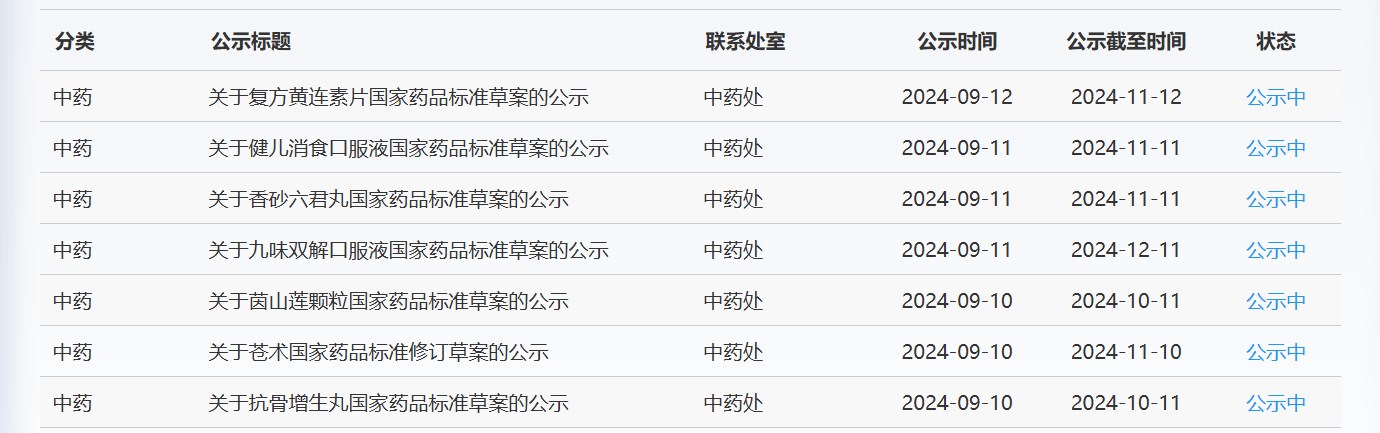
近期,藥典委發布的標準草案公示如下:
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-83057670
Hotline服務熱線:010-83057670
 簡體中文
簡體中文

 010-83057670
010-83057670 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
